Hóa học 12 Cánh diều Bài 21 Sơ lược về phức chất
Hóa học 12 Cánh diều Bài 21 Sơ lược về phức chất
Hóa học 12 Sơ lược về phức chất
Bài 21 Sơ lược về phức chất
I. MỘT SỐ KHÁI NIỆM
- Phức chất đơn giản thường có một nguyên tử trung tâm liên kết với các phối tử bao quanh, được đặt trong dấu ngoặc vuông. Liên kết giữa nguyên tử trung tâm và phối tử trong phức chất là liên kết cho – nhận.
- Phối tử là phân tử hoặc anion đã cho cặp electron chưa liên kết (hay cặp electron hoá trị riêng).
- Nguyên tử trung tâm là cation kim loại hoặc nguyên tử kim loại có orbital trống đã nhận cặp electron chưa liên kết của phối tử.
- Một số ví dụ:
Phức chất | [Ag(NH3)2]+ | [CoF6]3- |
Nguyên tử trung tâm | Ag+ | Co3+ |
Phối tử | NH3 | F− |
Giải thích sự hình thành liên kết trong phức chất | Liên kết trong phức chất [Ag(NH3)2]+ được hình thành do phối tử NH3 cho cặp electron chưa liên kết vào AO trống của nguyên tử trung tâm Ag+. | Liên kết trong phức chất [CoF6]3- được hình thành do phối tử F- cho cặp electron chưa liên kết vào AO trống của nguyên tử trung tâm Co3+. |
Chú ý:
+ Trong thực tế, có những phức chất có nhiều hơn một nguyên tử trung tâm; có những phức chất chỉ có một phối tử.
+ Theo IUPAC, khi viết công thức hoá học của phức chất, nên hướng nguyên tử cho cặp electron hoá trị riêng trong phối tử về phía nguyên tử trung tâm. Ví dụ, nên viết [Fe(OH2)6]2+ thay vì [Fe(H2O)6]2+.
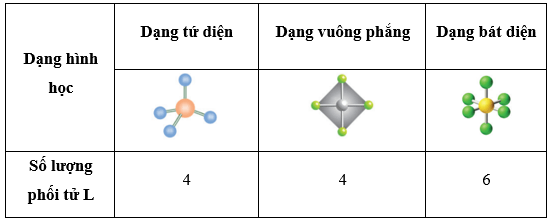
II. Dạng hình học của phức chất
Trong phức chất [MLn] (điện tích đã được lược bỏ), các phối tử L sắp xếp xác định xung quanh các nguyên tử trung tâm M tạo ra các dạng hình học khác nhau, phổ biến nhất là dạng tứ diện, vuông phẳng và bát diện.
Ví dụ:
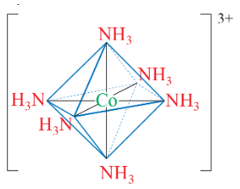
- [Co(NH3)6]3+ là phức chất bát diện, với dạng hình học như sau:
Trong phức chất này, các phối tử chiếm vị trí 6 đỉnh, còn nguyên tử trung tâm nằm ở tâm của hình bát diện.
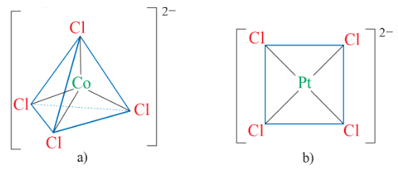
- Phức chất [CoCl4]2- là phức chất tứ diện (a); phức chất [PtCl4]2- là phức chất vuông phẳng (b):
Xem thêm:
Lý thuyết Hóa học 12 chương 8 Sơ lược về kim loại chuyển tiếp dãy thứ nhất và phức chất
Nhận xét
Đăng nhận xét