Hóa học 10 Cánh diều Bài 3 Nguyên tố hóa học
Hóa học 10 Cánh diều Bài 3 Nguyên tố hóa học
Bài 3: Nguyên tố hóa học
I. Nguyên tố hóa học
1. Khái niệm nguyên tố hóa học
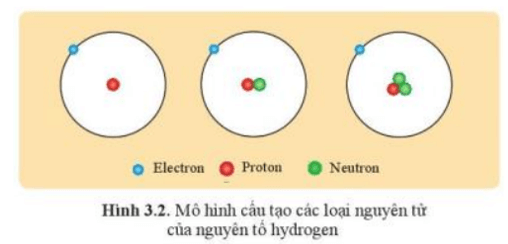
Các nguyên tử mà hạt nhân có cùng số hạt proton thuộc về cùng một nguyên tố hóa học.
Ví dụ: Ba loại nguyên tử hydrogen (H) đều có cùng một proton trong hạt nhân nên thuộc cùng một nguyên tố hóa học, nguyên tố hydrogen (H).
Chú ý:
- Cho đến năm 2020 đã có 118 nguyên tố được xác định, trong đó có 94 nguyên tố có nguồn gốc tự nhiên, còn lại là các nguyên tố nhân tạo.
- Nguyên tố phổ biến nhất trên Trái Đất là oxygen (O), chiếm khoảng 46,6% về khối lượng; tiếp theo là silicon (Si), chiếm khoảng 27,7% về khối lượng.
2. Số hiệu nguyên tử, số khối, kí hiệu nguyên tử
- Số proton trong một hạt nhân nguyên tử được gọi là số hiệu nguyên tử, kí hiệu là Z.
Ví dụ: Hạt nhân nguyên tử helium (He) có 2 proton, vậy số hiệu nguyên tử của He là 2 (ZHe = 2).
- Tổng số proton (Z) và neutron (N) trong một hạt nhân nguyên tử được gọi là số khối, kí hiệu là A.
A = Z + N
Chú ý: Số khối chính bằng tổng số hạt có trong hạt nhân nguyên tử. Giá trị này xấp xỉ bằng giá trị khối lượng nguyên tử (khi tính theo đơn vị amu).
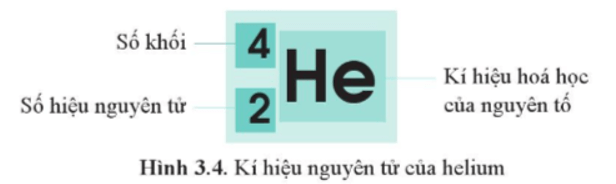
- Kí hiệu nguyên tử cho biết kí hiệu hóa học của nguyên tố (X), số hiệu nguyên tử (Z) và số khối (A).
Ví dụ: Kí hiệu nguyên tử của helium là , cho biết:
+ Nguyên tử He có số hiệu nguyên tử Z = 2.
+ Số khối là 4.
Chú ý: Đôi khi, người ta viết tắt kí hiệu nguyên tử. Ví dụ, sử dụng 4He thay cho , bởi kí hiệu He đã cho biết đây là nguyên tử nguyên tố helium, hạt nhân có 2 proton.
II. Đồng vị, nguyên tử khối trung bình
1. Đồng vị
Các nguyên tử của cùng một nguyên tố hóa học có hạt nhân khác nhau về số neutron là đồng vị của nhau. Do đó, các đồng vị của cùng một nguyên tố hóa học (có cùng số proton) khác nhau về số khối do có số neutron khác nhau.
Ví dụ: Hydrogen có các đồng vị là (kí hiệu là H), (kí hiệu là D), (kí hiệu là T), …; Carbon có các đồng vị là , , …
2. Nguyên tử khối trung bình
Nguyên tử khối
Nguyên tử khối là khối lượng tương đối của một nguyên tử, cho biết khối lượng của một nguyên tử nặng gấp bao nhiêu lần 1 amu.
Ví dụ: Nguyên tử khối của 12C là 12 do khối lượng của một nguyên tử 12C là 12 amu.
Nguyên tử khối trung bình
- Nguyên tử khối của một nguyên tố hóa học có nhiều đồng vị là nguyên tử khối trung bình của các đồng vị, có tính đến tỉ lệ số nguyên tử các đồng vị tương ứng.
- Công thức tính nguyên tử khối trung bình của nguyên tố X:
Trong đó:
: là nguyên tử khối trung bình của X
X, Y, Z …: lần lượt là số khối của các đồng vị.
x, y, z… là phần trăm số nguyên tử của các đồng vị tương ứng.
Ví dụ: Trong tự nhiên, silver có có hai đồng vị: 107Ag và 109Ag chiếm lần lượt 51,86% và 48,14% số nguyên tử tương ứng. Nguyên tử khối trung bình của Ag là:
Chú ý: Nguyên tử khối của một nguyên tố hóa học ghi trong bảng tuần hoàn là nguyên tử khối trung bình của các đồng vị trong tự nhiên.
Kết luận:
Nguyên tố hóa học là tập hợp các nguyên tử có cùng số proton trong hạt nhân, hay chính là cùng số hiệu nguyên tử Z. Việc xác định nguyên tố dựa trên số proton giúp ta phân loại, sắp xếp và nghiên cứu tính chất của vật chất một cách khoa học. Từ khái niệm này, bảng tuần hoàn được xây dựng như “bản đồ hóa học”, phản ánh quy luật biến đổi tuần hoàn của các nguyên tố và hợp chất.
Hiểu rõ về nguyên tố hóa học không chỉ là nền tảng để học các kiến thức tiếp theo về liên kết hóa học, phản ứng hóa học, mà còn giúp giải thích nhiều hiện tượng trong tự nhiên và công nghệ hiện đại. Như vậy, nguyên tố hóa học chính là “chìa khóa” mở ra thế giới hóa học đa dạng và phong phú quanh ta.
Xem thêm








Nhận xét
Đăng nhận xét