Hóa học 10 Cánh diều Bài 15 Ý nghĩa và cách tính biến thiên enthalpy phản ứng hóa học
Hóa học 10 Cánh diều Bài 15 Ý nghĩa và cách tính biến thiên enthalpy phản ứng hóa học
Hóa học 10 Ý nghĩa và cách tính biến thiên enthalpy phản ứng hóa học
Bài 15 Ý nghĩa và cách tính biến thiên enthalpy phản ứng hóa học
I. Ý nghĩa về dấu và giá trị của biến thiên enthalpy phản ứng
Với các phản ứng có kèm theo sự trao đổi năng lượng dưới dạng nhiệt, có hai khả năng sau đây:
1. Phản ứng tỏa nhiệt: biến thiên enthalpy của phản ứng có giá trị âm. Biến thiên enthalpy càng âm, phản ứng tỏa ra càng nhiều nhiệt.
2. Phản ứng thu nhiệt: biến thiên enthalpy của phản ứng có giá trị dương. Biến thiên enthalpy càng dương, phản ứng thu vào càng nhiều nhiệt.
Ví dụ: Cho phản ứng đốt cháy methane và acetylene:
(1) CH4(g) + 2O2(g) CO2(g) + 2H2O(l) = -890,5 kJ
(2) C2H2(g) + O2(g) 2CO2(g) + H2O(l) = -1300,2 kJ
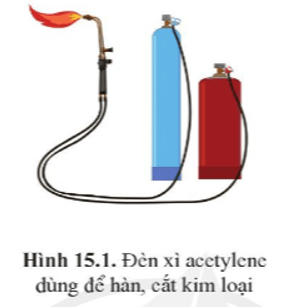
Khi đốt cháy cùng một thể tích khí CH4 và C2H2, lượng nhiệt do C2H2 sinh ra nhiều gấp khoảng 1,5 lần lượng nhiệt do CH4 sinh ra. Đây là lí do trong thực tế, người ta sử dụng C2H2 trong đèn xì để hàn, cắt kim loại mà không dùng CH4.
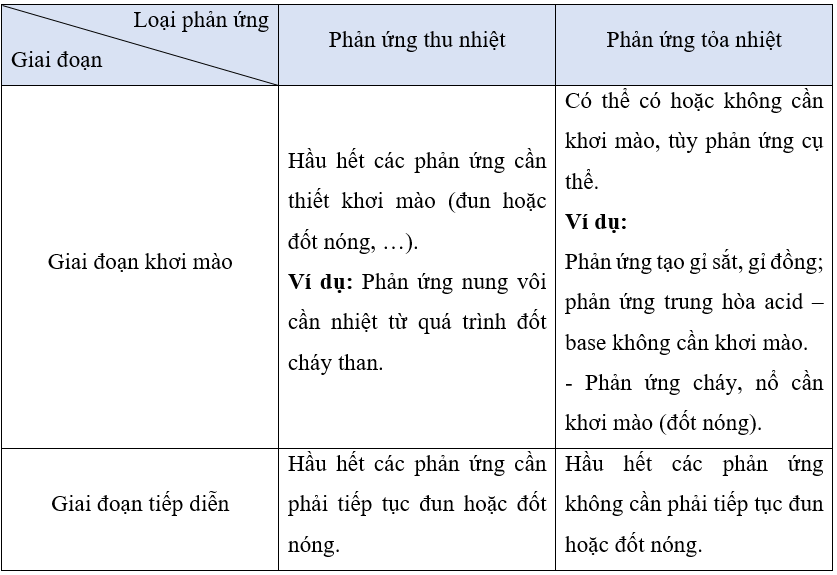
So sánh phản ứng thu nhiệt và phản ứng tỏa nhiệt:
Chú ý: Các phản ứng tỏa nhiệt ( < 0) thường diễn ra thuận lợi hơn các phản ứng thu nhiệt ( > 0).
Ví dụ: Sau khi được đốt nóng, Na tự cháy trong oxygen cho đến hết do phản ứng này có rất âm.
2Na(s) + O2(g) Na2O(s) = -418,0 kJ
Phản ứng này diễn ra thuận lợi hơn rất nhiều so với phản ứng giữa I2 và H2. Ở điều kiện chuẩn, phản ứng này chỉ xảy ra khi được đốt nóng (cung cấp nhiệt); khi dừng đốt nóng, phản ứng sẽ dừng lại.
H2(g) + I2(s) HI(g) = 26,5 kJ
II. Cách tính biến thiên enthalpy của phản ứng
1. Tính biến thiên enthalpy phản ứng theo enthalpy tạo thành
Giả sử có phản ứng tổng quát: aA + bB mM + nN.
Biến thiên enthalpy chuẩn của phản ứng này được tính theo công thức:
= m(M) + n(N) – a(A) – b(B).
Ví dụ 1: Cho phản ứng: 2NaCl(s) 2Na(s) + Cl2(g).
Biến thiên enthalpy chuẩn của phản ứng này được tính như sau:
= 2×(Na(s)) + 1×(Cl2(g)) – 2(NaCl(s))
= 2×0 + 1×0 – 2×(-411,2) = 822,4 (kJ)
Ví dụ 2: Tính biến thiên enthalpy của phản ứng đốt cháy hoàn toàn 1 mol ethane (C2H6).
C2H6(g) + O2(g) 2CO2(g) + 3H2O(l)
Biết: (C2H6) = -84,0 kJ mol-1; (CO2) = -393,5 kJ mol-1; (H2O) = -285,8 kJ mol-1.
Biến thiên enthalpy chuẩn của phản ứng là:
= 2×(CO2) + 3×(H2O) - (C2H6) - ×(O2)
= 2×(-393,5) + 3×(-285,8) – (-84,0) – ×0 = -1560,4 kJ.
2. Tính biến thiên enthalpy phản ứng theo năng lượng liên kết
Giả sử có phản ứng tổng quát: aA(g) + bB(g) mM(g) + nN(g).
Biến thiên enthalpy chuẩn của phản ứng này được tính theo công thức:
= aEb(A) + bEb(B) – m×Eb(M) – n×Eb(N).
Trong đó, Eb(A), Eb(B), Eb(M), Eb(N) lần lượt là tổng năng lượng liên kết trong các phân tử A, B, M và N.
Ví dụ 1: Cho phản ứng: CH4(g) + Cl2(g) CH3Cl(g) + HCl(g).
Biến thiên enthalpy chuẩn của phản ứng trên được tính theo năng lượng liên kết như sau:
= 1×Eb(CH4) + 1×Eb(Cl2) – 1×Eb(CH3Cl) – 1×Eb(HCl)
= 1×4EC-H + 1×ECl-Cl – 1×(3EC-H + EC-Cl) – 1×EH-Cl
= 1×4×414 + 1×243 – 1×(3×414 + 339) – 1×431 = -113 (kJ)
Ví dụ 2: Dựa vào năng lượng liên kết, tính của phản ứng sau:
F2(g) + H2O(g) 2HF(g) + O2(g)
Biết năng lượng liên kết: EF-F = 159 kJ mol-1; EO-H = 464 kJ mol-1; EH-F = 565 kJ mol-1;
kJ mol-1.
Biến thiên chuẩn của phản ứng được tính như sau:
= 1×Eb(F2) + 1×Eb(H2O) - 2× Eb(HF) - × Eb(O2)
= 1×EF-F + 1×2×EO-H - 2×EH-F -
= 159 + 2×464 - 2×565 - ×498 = -292 kJ.
Xem thêm
Nhận xét
Đăng nhận xét