Hóa học 10 Cánh diều Bài 10 Liên kết ion
Hóa học 10 Cánh diều Bài 10 Liên kết ion
Bài 10: Liên kết ion
I. Khái niệm và sự hình thành liên kết ion
1. Khái niệm
- Liên kết ion được hình thành bởi lực hút tĩnh điện giữa các ion mang điện tích trái dấu.
Ví dụ: Liên kết ion trong hợp chất NaCl tạo bởi lực hút tĩnh điện giữa ion dương Na+ và ion âm Cl-.
Na+ + Cl- NaCl
- Liên kết ion cũng có thể được hình thành từ ion đa nguyên tử, ví dụ như quá trình:
K+ + KNO3
+ NH4NO3
Mg2+ + MgCO3
- Các hợp chất được tạo nên từ cation và anion gọi là hợp chất ion.
Chú ý:
Khi các phần tử mang điện tích trái dấu hút nhau tạo thành liên kết hóa học, năng lượng của hệ giảm đi (quá trình tỏa năng lượng), nên tạo ra hệ bền vững hơn.
2. Sự hình thành liên kết ion từ phản ứng giữa các nguyên tử
Các nguyên tử trung hòa về điện nên để hình thành liên kết ion, cần trải qua hai giai đoạn sau đây:
Giai đoạn 1: Hình thành các ion trái dấu từ các quá trình kim loại nhường electron và phi kim nhận electron theo quy tắc octet.
Nguyên tử kim loại điển hình nhường electron tạo thành cation. Nguyên tử phi kim điển hình nhận electron tạo thành anion.
Ví dụ:
Nguyên tử Na (Z = 11) có cấu hình electron là [Ne]3s1, có 1 electron ở lớp ngoài cùng.
Nguyên tử Na nhường 1 electron để tạo thành ion Na+:
Na Na+ + 1e.
Nguyên tử Cl (Z = 17) có cấu hình electron là [Ne]3s23p5, có 7 electron ở lớp ngoài cùng.
Nguyên tử Cl nhận 1 electron để tạo thành ion Cl-:
Cl + 1e Cl-.
Giai đoạn 2: Các ion trái dấu hút nhau bằng lực hút tĩnh điện tạo nên hợp chất ion. Các ion trái dấu kết hợp với nhau theo tỉ lệ sao cho tổng điện tích của các ion trong hợp chất phải bằng không.
Na+ + Cl- NaCl
Nhận xét: Liên kết ion được hình thành giữa kim loại điển hình và phi kim điển hình.
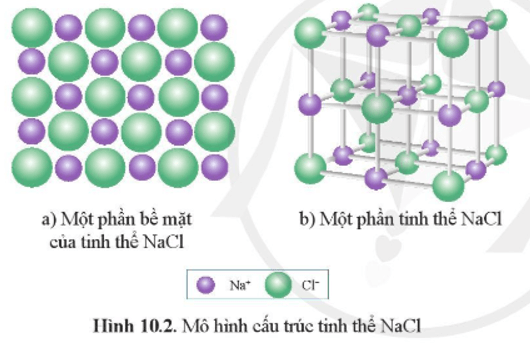
II. Tinh thể ion
Ở điều kiện thường, các hợp chất ion tồn tại ở dạng tinh thể, đó là các chất rắn mà sự sắp xếp các cation và anion trong không gian tuân theo một trật tự nhất định tạo nên tinh thể ion.
1. Khái niệm
Tinh thể ion là loại tinh thể được tạo nên bởi các cation và anion.
Ví dụ: Tinh thể muối ăn NaCl được hình thành từ các ion Na+ và Cl- sắp xếp cạnh nhau một cách luân phiên.
2. Đặc điểm của hợp chất ion
Các phần tử tạo nên hợp chất ion là các cation và anion. Chúng hút nhau mạnh bằng lực hút tĩnh điện. Do vậy, các phần tử này không chuyển động tự do được. Đây là lí do vì sao các hợp chất ion thường là tinh thể rắn ở điều kiện thường. Cũng vì lí do này, các hợp chất ion có nhiệt độ nóng chảy và nhiệt độ sôi rất cao.
Ví dụ: NaCl nóng chảy ở 801oC, sôi ở 1465oC; NaF nóng chảy ở 993oC, sôi ở 1695oC; CaO nóng chảy ở 2572oC, sôi ở 2850oC.
3. Mở rộng: Nuôi tinh thể muối ăn
Bước 1: Tạo dung dịch nước muối quá bão hòa: Cho muối ăn (muối tinh) vào khoảng 500ml nước sôi, khuấy đều cho đến khi muối ăn không thể tan thêm được nữa, để nguội và gạn lọc bỏ cặn lắng, thu được nước muối quá bão hòa.
Bước 2: Tạo tinh thể mầm: Rót khoảng 50 mL dung dịch muối quá bão hòa vào cốc, để trong ngăn mát tủ lạnh 5 – 7 ngày sẽ thu được tinh thể mầm. Chọn lấy tinh thể mầm to nhất trong số các tinh thể thu được.
Bước 3: Nuôi tinh thể: Buộc tinh thể mầm vào dây chỉ, treo vào giữa 450 mL dung dịch nước muối còn lại. Để yên, tránh bụi nhưng không đậy nắp vì để nước bay hơi. Nếu mầm tan thì buộc lại mầm mới, nếu sau 2 – 3 ngày mầm không tan thì sau một thời gian sẽ thu được tinh thể NaCl lớn hơn phát triển từ mầm này. Để lưu giữ các tinh thể NaCl, có thể dùng sơn bóng (sơn móng tay chẳng hạn) sơn lên bề mặt tinh thể.
Chú ý: Có thể thay NaCl bằng muối khác như CuSO4 hay phèn chua …
Xem thêm

Nhận xét
Đăng nhận xét